Bài giảng Hóa sinh động vật - Chương VI: Trao đổi amino acid và protein
NỘI DUNG
• I. ĐẶC ĐIỂM TRAO ĐỔI PROTEIN Ở ĐỘNG VẬT
• II. TIÊU HÓA VÀ HẤP THU
• III. SỰ CHUYỂN HOÁ AMINO ACID
– 3.1. Phản ứng khử amine hoá
– 3.2. Phản ứng khử carboxyl
– 3.3. Phản ứng chuyển amine
– 3.4. Sự bài tiết các chất cặn bã chứa nitơ
• IV. SINH TỔNG HỢP AMINO ACID
• V. SINH TỔNG HỢP PROTEIN
Bạn đang xem 20 trang mẫu của tài liệu "Bài giảng Hóa sinh động vật - Chương VI: Trao đổi amino acid và protein", để tải tài liệu gốc về máy hãy click vào nút Download ở trên
Tóm tắt nội dung tài liệu: Bài giảng Hóa sinh động vật - Chương VI: Trao đổi amino acid và protein
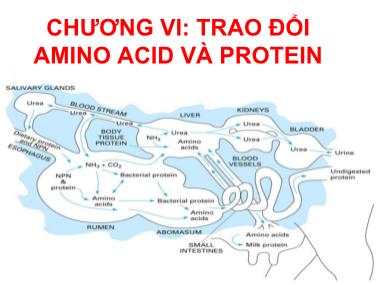
CHƢƠNG VI: TRAO ĐỔI AMINO ACID VÀ PROTEIN NỘI DUNG • I. ĐẶC ĐIỂM TRAO ĐỔI PROTEIN Ở ĐỘNG VẬT • II. TIÊU HÓA VÀ HẤP THU • III. SỰ CHUYỂN HOÁ AMINO ACID – 3.1. Phản ứng khử amine hoá – 3.2. Phản ứng khử carboxyl – 3.3. Phản ứng chuyển amine – 3.4. Sự bài tiết các chất cặn bã chứa nitơ • IV. SINH TỔNG HỢP AMINO ACID • V. SINH TỔNG HỢP PROTEIN I. Đặc điểm trao đổi protein ở động vật • Các acid amin đƣợc hấp thu theo một tƣơng quan số lƣợng nhất định – Tỷ lệ % các acid amin thiết yếu theo lysin đối với lợn con theo K. William Lys 100 Tyr + Phe 78 Met + Cys 34 Thr 45 Trp 9 Leu 85 His 33 Ile 47 Val 12 I. Đặc điểm trao đổi protein ở động vật • Cơ thể động vật không có khả năng dự trữ protein – Cân bằng nitơ dƣơng • Nitơ ăn vào > nitơ thải ra. – Cân bằng nito âm • Nitơ ăn vào < nitơ thải ra. – Cân bằng • Nitơ ăn vào = nitơ thải ra. Trạng thái cân bằng nitơ I. Đặc điểm trao đổi protein ở động vật • Lƣợng protein tối thiểu – Là lượng protein cần thiết để duy trì sự phát triển bình thường của cơ thể ở trạng thái nghỉ ngơi hoàn toàn. Loài động vật Lƣợng pr tối thiểu (g/kgP/ngày đêm) Cừu 1,00 Lợn 1,00 Ngựa 0,70-1,42 Bò cạn sữa 0,60-0,70 Bò đang tiết sữa 1,00 Người 1,00-1,50 I. Đặc điểm trao đổi protein ở động vật • Acid amin có sự trao đổi riêng I. Đặc điểm trao đổi protein ở động vật • Sinh tổng hợp protein cũng có nét đặc trƣng khác biệt. II. TIÊU HÓA VÀ HẤP THU • 2.1. Tiêu hóa protein ở động vật dạ dày đơn 2.1. Tiêu hóa protein ở động vật dạ dày đơn • Dạ dày: – Pepsin: thủy phân lk peptide có nhóm amin của aa có nhân thơm (Phe, Tyr và Trp). – Pepsin không thủy phân được keratin. – Chymosin (rennin) trong dạ dày gia súc non chuyển hóa casein → paracasein. • Ruột non: – Trypsin (pH: 7-8): thủy phân lk peptide có nhóm –CO- của aa kiềm tính như Lys và Arg. – Chymotrypsin (pH: 8): thủy phân lk peptide có nhóm –CO- của aa Phe, Tyr và Trp. – Carboxypeptidase: thủy phân lk đầu C của chuỗi peptide. – Aminopeptidase: thủy phân lk đầu N của chuỗi peptide. – Protaminase, prolinase. 2.2. Hấp thu protein và amino acid ở động vật dạ dày đơn 2.2. Hấp thu protein và amino acid ở động vật dạ dày đơn 2.3. Chuyển hóa các hợp chất chứa nitơ ở động vật nhai lại III. CHUYỂN HÓA AMINO ACID • 3.1. Các phản ứng điển hình trong phân giải acid amin – Phản ứng khử amin oxy hóa • Khử amin oxy hóa của glutamate • Khử amin oxy hóa của các acid amin khác – Phản ứng chuyển amin – Phản ứng khử nhóm carboxyl Khử amin oxy hóa của glutamate • Glutamate khi vào ty thể, nhờ enzyme glutamate dehydrogenase có coenzyme NAD+ (chiếm ưu thế) hoặc NADP+. Khử amin oxy hóa của các acid amin khác • Xảy ra ở bào tương, nhờ enzyme oxidase có nhóm ghép là FMN. Phản ứng chuyển amin • Enzyme transaminase có nhóm ghép pyridoxal phosphate (PLP) là dẫn xuất của vitamin B6 Glutamate:Oxaloacetate Transaminase (GOT) hoặc Aspartate Transaminase Glutamate-Pyruvate Transaminase (GPT) or Alanine Transaminase • Alanine là một aa quan trọng được giải phóng từ mô cơ khi cơ thể bị đói kéo dài. • Alanine là một cơ chất quan trọng cho quá trình tổng hợp đường, phản ứng chuyển amine của anlanine rất cần thiết cho sự duy trì nồng độ glucose trong máu. Phản ứng khử carboxyl • Xúc tác bởi decarboxylase có nhóm ghép là pyridoxalphosphate (PLP) dẫn xuất của vitamin B6. Một số amine hữu cơ quan trọng AA Amine Ý nghĩa Serine Etanolamine Cấu tạo các phospholipid Cysteine Cysteamine Cấu tạo CoA Histidine Histamine Tăng tiết dịch vị, các phản ứng dị ứng Lysine Cadaverin Cấu tạo ribosom, là chất độc Glutamate GABA Ảnh hưởng đến hoạt động thần kinh 3.2. Bài tiết các hợp chất chứa nitơ 3.2. Bài tiết các hợp chất chứa nitơ • 3.2.1. Tổng hợp và bài tiết urê • Hầu hết động vật thủy sinh đào thải trực tiếp NH4 + vào môi trường. • Ở động vật có vú dạng chất bài tiết chính của NH4 + là urê và alantoin. • Ở chim và bò sát sản phẩm bài tiết chính là acid uric dưới dạng urate (Na+, K+) ít hòa tan. - Diễn ra ở ty thể và ở tế bào chất của tế bào gan ở động vật bài tiết ure. - Một N của urea được lấy từ Asp. - Một N được lấy từ NH4 +. - Một O được lấy từ CO2. - Ornithine hoạt động như chất mang các phân tử trong quá trình tổng hợp urea. Nguồn gốc các phân tử Ý nghĩa • NH4 + là sản phẩm của quá trình phân giải amino acids. • NH4 + là nguyên liệu cần thiết cho tế bào tổng hợp các hợp chất chứa N. • Khi thừa NH4 + dẫn đến tình trạng ngộ độc. • Lượng NH4 + dư sẽ được chuyển hóa thành ure thông qua vòng ure và được đào thải ra ngoài cơ thể. Khoảng 80% lượng N bị thải ra ngoài cơ thể qua vòng urea. 3.2.2. Tổng hợp và bài tiết acid uric • Acid uric là dạng bài tiết chất cặn bã chứa nitơ chủ yếu của các loài chim, bò sát và các loài nhuyễn thể. • NH4 + bài tiết kết hợp với glutamate, tạo thành glutamine, chất này cùng aspartate, glycine, formate và CO2 tạo thành gốc kiềm purine, rồi gốc kiềm purine sẽ phân giải để cho ra acid uric • Nguồn gốc của nitơ trong phân tử acid uric: 3.3. Sự chuyển hóa các bộ khung C của amino acid IV. SINH TỔNG HỢP AMINO ACID • 4.1. Vòng luân chuyển nitơ trong tự nhiên 4.2. Tổng hợp acid amin • Thực vật: tổng hợp tất cả các aa từ các nguồn nitơ như NH4 +, NO3 - hay NO2 - (VD: cây họ đậu, nhờ các vsv cố định nitơ cộng sinh, có thể t/hợp được aa từ N2 • VSV: khả năng tổng hợp aa khác nhau. Phần lớn cần NH4 + làm nguồn nitơ; một số vsv giống như th/vật, có kh/năng s/dụng NO3 - , t/hợp được tất cả các aa. Với một số loài, một số aa cũng là EAA. • Động vật sử dụng N hữu cơ trong các aa để t/hợp các aa. Nhiều loại aa không được t/hợp ở ĐV; ĐV nhận các aa này qua TĂ. Đây là các EAA. Khái quát về sinh tổng hợp các acid amin Đặc điểm của quá trình sinh tổng hợp aa • Bộ khung carbon của aa bắt nguồn từ các sản phẩm trung gian của q/trình đường phân, vòng pentosephosphate hay vòng Krebs. • Sự tổng hợp một số aa bắt nguồn từ những tiền chất chung và qua nhiều SPTG giống nhau. • Có 6 con đường STH các amino acid: Các con đƣờng tổng hợp amino acid V. SINH TỔNG HỢP PROTEIN • 5.1. Các yếu tố tham gia vào quá trình sinh tổng hợp protein – RNA thông tin (mRNA) và mã di tryền. – RNA vận chuyển (transfer RNA, tRNA) – Ribosome – Các enzyme – Các yếu tố mở đầu, kéo dài và kết thúc – Năng lượng và các cation cần thiết cho quá trình dịch mã – Các aa là nguyên liệu để tổng hợp nên chuỗi polypeptide của phân tử protein RNA thông tin (mRNA) và mã di tryền RNA vận chuyển (transfer RNA, tRNA) Cấu trúc bậc II của tRNA Cấu trúc không gian 3 chiều của tRNA ở nấm men Ribosome Các yếu tố mở đầu, kéo dài và kết thúc Prokaryote (E. coli) Eukaryote Vai trò Vai trò Yếu tố mở đầu IF1 Phân ly ribosome Tạo thuận lợi cho liên kết của tổ hợp fMet-tRNA-IF2.GTP eIF-1 Gắn mRNA, ổn định phức hợp mở đầu IF2 Gắn f.Met-tRNA vào 30S, hoạt tính GTPase eIF-2 eIF-2α eIF-2 eIF-2γ Gắn Met-tRNA vào 40S IF3 Gắn mRNA vào 30S eIF-2B (từ α đến ) Tái tạo IF2.GTP từ IF2.GDP eIF-3 Ổn định phức hợp mở đầu eIF-4 (từ A đến F) Nhận biết và gắn mRNA vào 40S, ổn định phức hợp mở đầu. eIF-5 Giải phóng eIF-2 và eIFF-3 từ phức hợp mở đầu, gắn 60S. Yếu tố kéo dài EF-Tu Gắn aa-tRNA vào phức hợp dịch mã, GTPase eEF-1 (từ α đến γ) Gắn aa-tRNA vào phức hợp dịch mã, GTPase EF-Ts Tái tạo EF-Tu.GTP eEF-2 Tái tạo eEF-Tu.GTP EF-G Chuyển vị, GTPase eEF-G Chuyển vị, GTPase Yếu tố kết thúc RF1 RF2 Kết thúc kéo dài, giải phóng tRNA, RF2 có hoạt tính GTPase eRF Tách rời sợi polypeptide được tổng hợp khỏi tRNA RF3 Kích thích liên kết và giải phóng RF1 và RF2 khỏi ribosome RRF Giải phóng ribosome khỏi mRNA 5.2. Cơ chế sinh tổng hợp protein • Giai đoạn hoạt hóa amino acid • Tạo phức hợp mở đầu • Kéo dài chuỗi polypeptide • Giai đoạn kết thúc • Biến đổi sau dịch mã Các thành viên tham gia 5 giai đoạn sinh tổng hợp protein Giai đoạn Ở tế bào Procaryote Ở tế bào Eukaryote 1. Hoạt hóa Acid amin 20 loại acid amin, 20 loại aminoacyl-tRNA synthetase, tRNA, ATP, Mg++ 20 loại acid amin, 20 loại aminoacyl- tRNA synthetase, tRNA, ATP, Mg++ 2. Mở đầu f.Met-tRNA, Mã AUG trên mRNA, ribosome 30S, 50S. Các yếu tố mở đầu: IF1, IF2, IF3, GTP, Mg++ Met-tRNA, Mã AUG trên mRNA, ribosome 40S, 60S. Các yếu tố mỡ đầu: eIF2, eIF 4a, eIF 4c, eIF3, eIF5, GTP, Mg++ 3. Kéo dài Ribosome 70 S hoạt động, Aminoacyl-tRNA t/ ứng với mã, Yếu tố kéo dài: EF.Tu, EF.Ts, EF.G; peptidyl transferase, GTP, Mg++ Ribosome 80 S hoạt động, Aminoacyl-tRNA tương ứng với mã, Yếu tố kéo dài: eEF1 , eEF1, eEF2, peptidyl transferase, GTP, Mg++ 4. Kết thúc Mã kết thúc, Các yếu tố giải phóng: RF1, RF2, RF3, ATP Mã kết thúc, Yếu tố giải phóng: eRF, GTP, peptidyltransferase 5. Cải biến sau dịch mã Các enzyme đặc biệt và các yếu tố cho sự tách rời của đoạn mở đầu chuỗi polypeptide Các enzyme đặc biệt và các yếu tố cho sự tách rời của đoạn mở đầu chuỗi polypeptide Giai đoạn hoạt hóa amino acid Tạo phức hợp mở đầu Prokaryote Eukaryote mRNA gắn với tiểu phần nhỏ Đoạn Shine-Dalgarno trước mã mở đầu AUG gắn với đoạn bổ sung của rRNA 16S Mũ 5’ (5’cap) của mRNA gắn các yếu tố eIF và tiểu phần 40S chứa tRNAMet, mRNA được quét tới khi gặp mã AUG mở đầu. Ribosome 70S 80S Acid amin mở đầu Formyl-methionine (fMet) Methionine (Met) Các yếu tố mở đầu Ba yếu tố (IF1, IIF2 và IF3) Nhiều, trên 10 yếu tố eIF Chức năng của các yếu tố mở đầu Yếu tố Chức năng Procaryote: IF-1 gắn tRNA vào khu A. IF-2 Làm thuận lợi cho fMet-tRNAfMet gắn vào 30S, hoạt tính GTPase. IF-3 Gắn với 30S, làm tăng tính đặc hiệu của khu P đối với fMet-tRNAfMet. Eukaryote: eIF2 Gắn Met-tRNAMet với tiểu phần 40S. eIF2B, eIF3 Gắn các yếu tố đầu tiên với tiểu phần 40S, làm thuận lợi cho các bước tiếp theo. eIF4A Hoạt tính RNA helicase loại bỏ cấu trúc thứ cấp trong mRNA cho phép liên kết với tiểu phần 40S; một phần của phức hợp eIF4F. eIF4B Gắn với mRNA, làm thuận lợi cho việc quét mRNA để xác định vị trí codon AUG đầu tiên. eIF4E Gắn với mũ 5’CAP của mRNA; một phần của phức hợp eIF4F eIF4G Gắn với eIF4E và với PAB (polyA binding protein); một phần của phức hợp eIF4F. eIF5 Thúc đẩy một số yếu tố mở đầu khác tách khỏi tiểu phần 40S chuẩn bị cho tiểu phần 60S bám vào để tạo phức hợp mở đầu 80S. eIF6 Phân li ribosome 80S không hoạt động thành 2 tiểu phần 40S và 60S. Kéo dài chuỗi polypeptide Gắn aa-tRNA tiếp theo ở khu A Hình thành liên kết peptide Chuyển vị Giai đoạn kết thúc • Sự tổng hợp polypeptide kết thúc khi xuất hiện 1 trong các codon kết thúc trên mRNA (UAA,UAG,UGA) • Yếu tố tách rời: – RF1: nhận biết UAA, UAG – RF2: nhận biết UAA, UGA – RF3: gắn GTP • Enzyme peptidyl transferase thuỷ phân liên kết peptide (giữa polypeptide và tRNA ở vị trí P). • Ribosom 70S 30S + 50S tham gia tổng hợp một pr mới. Biến đổi sau dịch mã • Hầu hết các protein được loại bỏ acid amin mở đầu. • Nhiều protein được tổng hợp ở dạng tiền chất (chưa hoạt động), chúng sẽ được sửa đổi để trở thành dạng có hoạt tính. – Các protease tuyến tụy như chymotrypsin, trypsin và hormone insulin. • Thay đổi của acid amin riêng biệt trong chuỗi polypeptide. – Nhóm OH của Ser, Thr hay Tyr trong một số polypeptide được phosphoryl hóa bởi ATP. Biến đổi sau dịch mã • Gắn thêm nhóm ghép – Biotin trong enzyme acetyl-CoA-carboxylase hoặc heme trong cytochrome c • Tạo thành liên kết disulfide – Các protein ra ngoài từ tế bào có nhân sau thường hình thành các cầu disulfide giữa 2 cysteine trong một chuỗi hoặc giữa các chuỗi polypeptide
File đính kèm:
 bai_giang_hoa_sinh_dong_vat_chuong_vi_trao_doi_amino_acid_va.pdf
bai_giang_hoa_sinh_dong_vat_chuong_vi_trao_doi_amino_acid_va.pdf

